Mecanismo encontrado na erva chinesa ajuda a criar enzimas em laboratório, o que pode acelerar o desenvolvimento de medicamentos e até de uma supercola.
Cientistas da Universidade Tecnológica de Nanyang, em Cingapura (NTU Cingapura) identificaram como uma classe especial de enzimas derivadas de plantas, conhecidas como peptídeo-ligases, trabalham para unir proteínas. Esse tipo de ligação é extremamente importante no desenvolvimento de medicamentos, por exemplo: em um tratamento de quimioterapia, busca-se que a droga quimioterápica se ligue especificamente a um anticorpo que reconheça marcadores de tumor, de modo a tomar as células cancerosas como alvo.
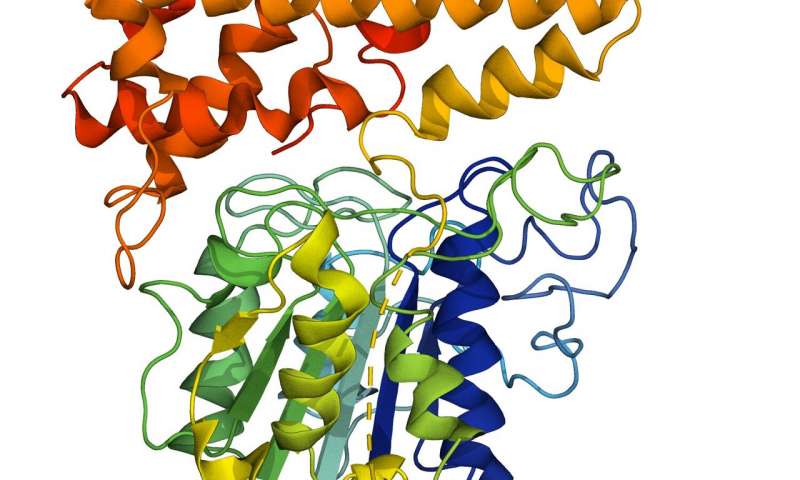
Essas enzimas, ligases peptídicas, podem grudar (trocadilho intencional) na engenharia por uma perspectiva da Engenharia Química e Biomédica. Por quê? Bem, elas são uma ferramenta útil em aplicações biotecnológicas e biomédicas, tais como rotulagem de proteínas, imagem e rastreamento de proteínas no corpo. Com isso, podem aparecer na indústria farmacêutica, para atuar como mediadora em diversos tratamentos.
Como funcionam as enzimas ligases?
Os cientistas da NTU Singapore mostraram que o segredo da
propriedade de “supercola” de uma peptídeo ligase reside em duas regiões
específicas da enzima que lhes dão a capacidade de se ligar a outras moléculas
e de alterar a taxa em que ela funciona.
A equipe do NTU usou seu conhecimento recém-descoberto para
desenvolver uma nova enzima peptídeo ligase, criada a partir de informações
genéticas da violeta chinesa (Viola
yedoensis), uma planta medicinal, com propriedades antibióticas e
anti-inflamatórias.

A enzima peptídeo ligase criada artificialmente, também
conhecida como peptídeo ligase recombinante, pode ajudar o desenvolvimento de
drogas feitas a partir de componentes retirados de organismos vivos, pois
supera as limitações dos métodos atuais, tais como subprodutos ou moléculas
tóxicas que podem alterar função e eficácia do medicamento.
O que ocorre atualmente é que, durante o desenvolvimento de
uma droga, as moléculas de proteína são “costuradas” quimicamente. Embora isso
seja eficiente, o processo deixa subprodutos que podem alterar a função do
produto final. As ligases peptídicas derivadas de plantas provaram ser uma
supercola de proteína mais confiável do que as ligases derivadas de bactérias,
ou o uso de substâncias químicas para ligar as proteínas.
PUBLICIDADE
CONTINUE LENDO ABAIXO
LEIA MAIS
Aplicações futuras:
A equipe registrou uma patente para criação de ligases a partir de proteases (outra enzima presente na planta), e também criou outro registro para a ligase recombinante em si. Nesse cenário, os pesquisadores estão desenvolvendo a enzima recombinante para a figura de um produto.
Os pesquisadores também estão trabalhando em parceria com escolas de medicina e instituições de saúde locais e estrangeiras para usar essa enzima recombinante em diagnóstico por imagem, como imagens de tumores cerebrais durante uma cirurgia.

Fonte: ScienceDaily.
PNAS.
Comentários

Kamila Jessie
Doutora em Hidráulica e Saneamento pela Universidade de São Paulo (EESC/USP) e Mestre em Ciências pela mesma instituição; é formada em Engenharia Ambiental e Sanitária pelo Centro Federal de Educação Tecnológica de Minas Gerais (CEFET-MG) com período sanduíche na University of Ottawa, no Canadá; possui experiência em tratamentos físico-químicos de água e efluentes; atualmente, integra o Centro de Pesquisa em Óptica e Fotônica (CePOF) do Instituto de Física de São Carlos (USP), onde realiza estágio pós-doutoral no Biophotonics Lab.


