No início do Século XX, Einstein revolucionou o mundo da Física ao apresentar suas Teorias da Relatividade (Restrita e Geral), trazendo uma nova visão sobre fenômenos que não podiam ser explicados com o ferramental disponível até então, que era a Física Clássica, brilhantemente organizada e desenvolvida por Isaac Newton.
Ainda assim, a nova Física continha (como todas teorias), algumas “falhas”, ou seja, não se aplicava em determinados domínios observados.
A melhor compreensão da natureza da luz, o estudo do comportamento da radiação, bem como a busca por um modelo de átomo, trouxe uma série de observações que não se encaixavam nas teorias disponíveis. E algumas observações eram nada, absolutamente nada intuitivas…
Richard Feynman, um grande físico teórico da segunda geração (a primeira eram Dirac, Einstein, Rutherford, Heinsenberg, Schrödinger, Planck, Bohr…) e que fez grandes avanços no campo da teoria quântica, afirmou que “embora saibamos realizar os cálculos, não entendemos a teoria de modo tão completo como deveríamos”.
Nesta matéria, apresentaremos o contexto que serviu de base e que precisava de explicações que vieram a ser encontradas na teoria quântica.
Linhas espectrais
O primeiro indício de uma revolução quântica ocorreu em 1885, irreconhecível como tal na época. Sua origem foram alguns rascunhos de um professor secundário suíço chamado Balmer.
PUBLICIDADE
CONTINUE LENDO ABAIXO
Linhas espectrais são uma espécie de assinatura ou impressão digital de um determinado gás. Quando a luz de um gás incandescente é dividida ao passar por um prisma, são encontradas linhas coloridas e bem definidas. Cada cor corresponde a uma frequência distinta (taxa de oscilação) das ondas de luz envolvidas. Para cada gás diferente, uma assinatura diferente.

Balmer, analisando o espectro do hidrogênio, descobriu que as frequências observadas eram obtidas de forma relativamente simples. Naquele tempo, isso foi encarado como uma mera curiosidade.
Pouco sabia-se sobre a natureza do átomo, mas era fato que o comportamento espectral dado por linhas coloridas e bem definidas, merecia alguma atenção. Principalmente quanto a sua natureza discreta e descontínua.
A natureza corpuscular da energia
Para entender a natureza corpuscular da energia, se faz necessária uma breve explicação do fenômeno conhecido como “radiação de corpo negro”. Esse fenômeno consiste, em linhas gerais, ao efeito que se observa quando um corpo muito aquecido emite radiação (pode ser um forno, um carro fechado num dia de sol, uma brasa ou uma estrela!).
PUBLICIDADE
CONTINUE LENDO ABAIXO
Lord Rayleight, ao estudar esse problema em 1900, aplicando conceitos da física estatística, se deparou com um problema chamado “catástrofe ultravioleta”. Com a formulação que tinha disponível, ele buscou explicar o problema e chegou a conclusões nada corretas, comparadas com os espectros de radiação observados. Pela formulação, ele previu que haveria uma concentração infinita de energia concentrada nas frequências mais altas (frequências altas – acima do violeta ou ultravioleta). Isso não batia em nada com as observações, que previam quantidades bem definidas de energia para as altas frequências.
Em um ano, Max Planck, professor de Física de Berlim, encontrara uma maneira notável de solucionar essa “catástrofe”. Ele chegou a comentar com seu filho, que fizera uma descoberta de significância comparada às de Newton. E ele estava falando absolutamente a verdade. Enquanto a Física Clássica tratava a energia como algo que fluía continuamente para dentro e para fora de um corpo negro, não era isso que ocorria. Para situações cotidianas, sujeitas a suaves mudanças, essa hipótese é válida, mas não para esse fenômeno.
Planck então propôs que a radiação era emitida ou absorvida de tempos em tempos em pacotes de energia de tamanho definido. E foi além: concluiu que o conteúdo energético de um desses quanta (como eram chamados os pacotes e que batizou essa nova Física Quântica anos mais tarde) seria proporcional à frequência da radiação. A constante de proporcionalidade foi tirada de uma constante universal da natureza, hoje conhecida como constante de Planck, representada por h=6,63e-34 J.s (uma quantidade realmente muito pequena para experiências cotidianas).
Essa hipótese ousada teve como consequência considerar que a radiação de alta frequência só poderia ser emitida ou absorvida em eventos que envolvessem um único quantum de energia significativamente alta. Essa grande tarifa energética significava que esses eventos de alta frequência seriam gravemente suprimidos em comparação às previsões da física clássica. Dessa forma, as altas frequências foram então subjugadas, eliminando-se portanto a “catástrofe ultravioleta”, além de gerar uma formulação em detalhada concordância com os resultados empíricos.
O efeito fotoelétrico
Havia um jovem que dispunha de tempo de sobra para estudar física teórica enquanto trabalhava como especialista técnico de terceira classe no escritório de patentes de Berna. Seu nome? Albert Einstein.
Em 1905, ele propôs a Teoria Restrita da Relatividade (TRR) e o Efeito Fotoelétrico, cuja genialidade só foi reconhecida 16 anos mais tarde, quando foi laureado com um Prêmio Nobel de Física. Em relação à TRR e à TGR, a academia sueca considerou essas teorias especulativas demais para serem reconhecidas por um Nobel. Mentes comuns têm alguma dificuldade em compreender mentes geniais e seus produtos.
Embora Einstein tenha relutado a aceitar a Teoria Quântica até seu último dia de vida (a ele é atribuída a famosa frase “Deus não joga dados com o Universo”, sobre sua posição à essa nova física), seu trabalho foi fundamental para a formulação dessa nova Teoria.
O Efeito Fotoelétrico é um fenômeno pelo qual um feixe de luz ejeta elétrons de dentro de um metal. Sabemos que os elétrons podem fluir num metal, a famosa corrente elétrica, mas não têm energia suficiente para escapar do metal. O efeito fotoelétrico em si não era novidade (Hertz estudou bem o fenômeno uns 20 anos antes): uma radiação incide no metal, transfere energia para os elétrons e alguns escapam.
Em um tipo de raciocínio clássico, os elétrons seriam agitados pela energia das ondas de luz. E por essa lógica, quanto maior a intensidade do feixe, maior a quantidade de energia e portanto maior a quantidade de elétrons que se desprenderiam do metal, independente da frequência da luz incidente. Faz sentido, só que não. Porque não é isso que ocorre. Na verdade, os experimentos mostravam justamente o oposto. Abaixo de uma determinada frequência crítica, não havia emissão de elétrons, por mais intenso que fosse o feixe; acima dessa frequência crítica, mesmo um feixe fraco era capaz de ejetar elétrons.
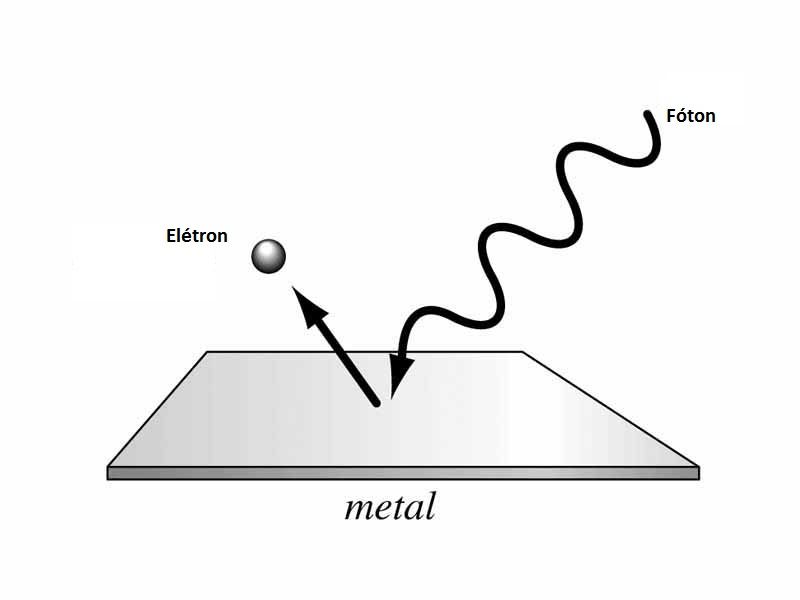
Esse comportamento intrigante fez com que o jovem Einstein refletisse sobre o tema e encontrasse uma explicação razoável pro fenômeno, desde que o feixe de luz fosse considerado uma corrente de quanta persistente. Um elétron seria ejetado pela colisão de um desses quanta que colidisse com ele, abrindo mão de toda sua energia. E a quantidade de energia nesse quantum, segundo Planck, era diretamente proporcional à frequência. Se a frequência fosse baixa demais, não haveria energia transferida em uma colisão para permitir que o elétron escapasse. Se fosse excedido o valor crítico da frequência, haveria energia suficiente para o elétron escapar.
Dessa maneira, a intensidade do feixe simplesmente dizia quantos quanta ele continha e, portanto, quantos elétrons estavam envolvidos em colisões e eram ejetados. Ou seja, o aumento da intensidade do feixe não poderia alterar a energia transferida em uma única colisão! Foi necessário então assumir a existência dos quanta de luz, que ganharam um nome próprio: fótons. Einstein explicou o efeito fotoelétrico considerando a natureza corpuscular da luz e contribuiu de forma brilhante à construção da teoria quântica.
E onde isso é aplicável? Bem, em época de rever conceitos energéticos, fontes renováveis e sustentáveis, você já deve ter ouvido falar em painéis solares, que basicamente usam a radiação solar para gerar energia elétrica.

Modelos atômicos
O átomo nuclear
Enquanto uns estudavam a luz, outros estudavam os átomos. Ernest Rutherford foi quem propôs o átomo como nos foi apresentado no colégio e faculdade: possuindo um núcleo positivo orbitado por elétrons negativos.

Esse é o modelo atômico “sistema solar”. A descoberta de um núcleo atômico conduziu a teoria eletromagnética clássica à sua crise mais profunda até então. Se os elétrons em um átomo estão circundando um núcleo, então estão mudando continuamente seu sentido de movimento. Para que isso ocorra, é premissa da teoria eletromagnética clássica que nesse processo, irradiem parte de sua energia. Conclusão: os elétrons deveriam então ter um movimento espiralado em direção ao núcleo. Essa conclusão foi mais desastrosa que a “catástrofe ultravioleta”, pois implicava que os átomos seriam instáveis. E mais: deveriam emitir um padrão contínuo de radiação que nunca fora observado. O modelo atômico requeria ajustes…
Átomo de Bohr
Niels Bohr, um físico teórico fez uma proposta revolucionária, aplicou aos átomos princípios semelhantes que Planck aplicara à radiação. Um físico clássico poderia supor que os elétrons circundando um núcleo poderiam assumir órbitas cujos raios assumiriam qualquer valor. Bohr assumiu então a hipótese de que isso não era verdade, ou seja, que os raios só podem assumir uma série de valores distintos e enumeráveis (primeiro, segundo, terceiro…). Ele também propôs que esses possíveis raios poderiam ser determinados usando uma formulação que envolvia a constante de Planck h.

Como consequência, o átomo voltou a ser estável. Uma vez que um elétron estivesse num estado correspondente ao menor raio possível, que também era o estado de menor energia, ele não tinha lugar algum para ir e, portanto, nenhuma energia adicional podia ser perdida. O elétron poderia ter chegado a este estado de menor energia, ao ter migrado de um raio correspondente a um estado de maior energia. Bohr propôs ainda que, nesse processo migratório de um estado de maior energia para um de menor energia, a energia excedente seria irradiada como um único fóton.
O movimento espiral contínuo fora substituído por um salto quântico fortemente descontínuo de uma órbita de raio permitido maior para uma órbita de raio permitido menor. E nesse processo, luz era emitida.
As bases estavam preparadas
Fundamental apresentar esses conceitos, uma vez que são peças-chave para a construção dessa nova física, onde o contínuo, dá lugar ao discreto.
Não é exagero algum pensar na teoria quântica como uma das realizações intelectuais mais incríveis do século XX. Sua descoberta viria a revolucionar nossa compreensão dos fenômenos físicos que regem a natureza como um todo. E as bases, estavam disponíveis, bastava organizá-las.
O que você acha da Física Quântica? Comente!
Comentários

Cristiano Oliveira da Silva
Engenheiro Civil; formado pela Escola Politécnica da Universidade de São Paulo; com conhecimentos em 'BIM Manager at OEC'; promove palestras com foco em Capacitação e Disseminação de BIM / Soft Skills.


